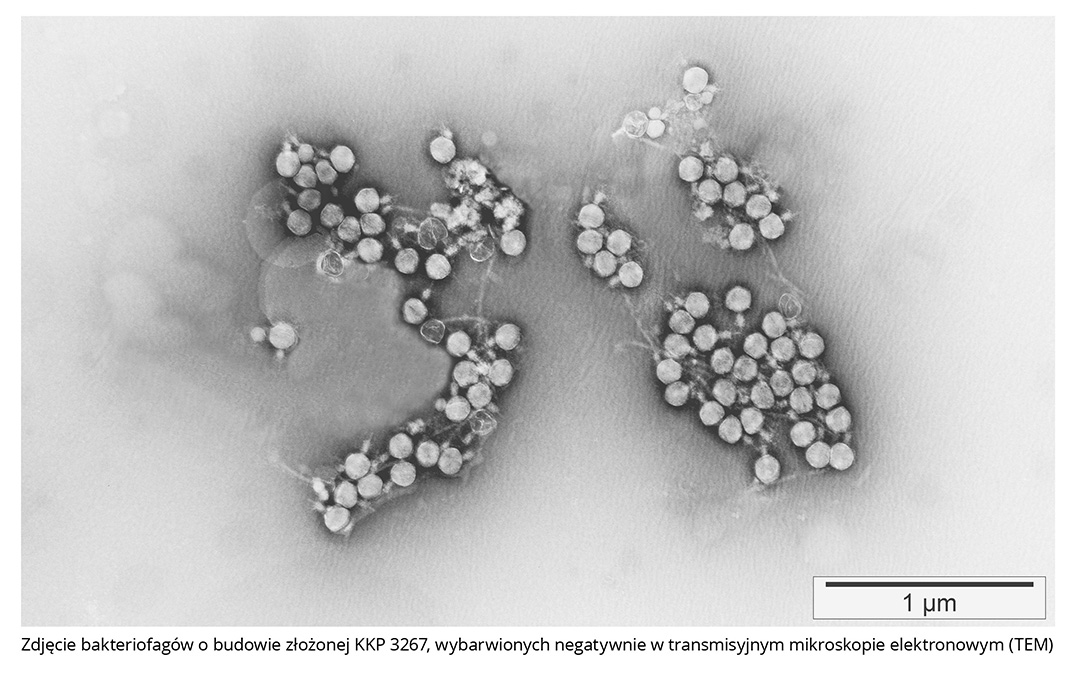
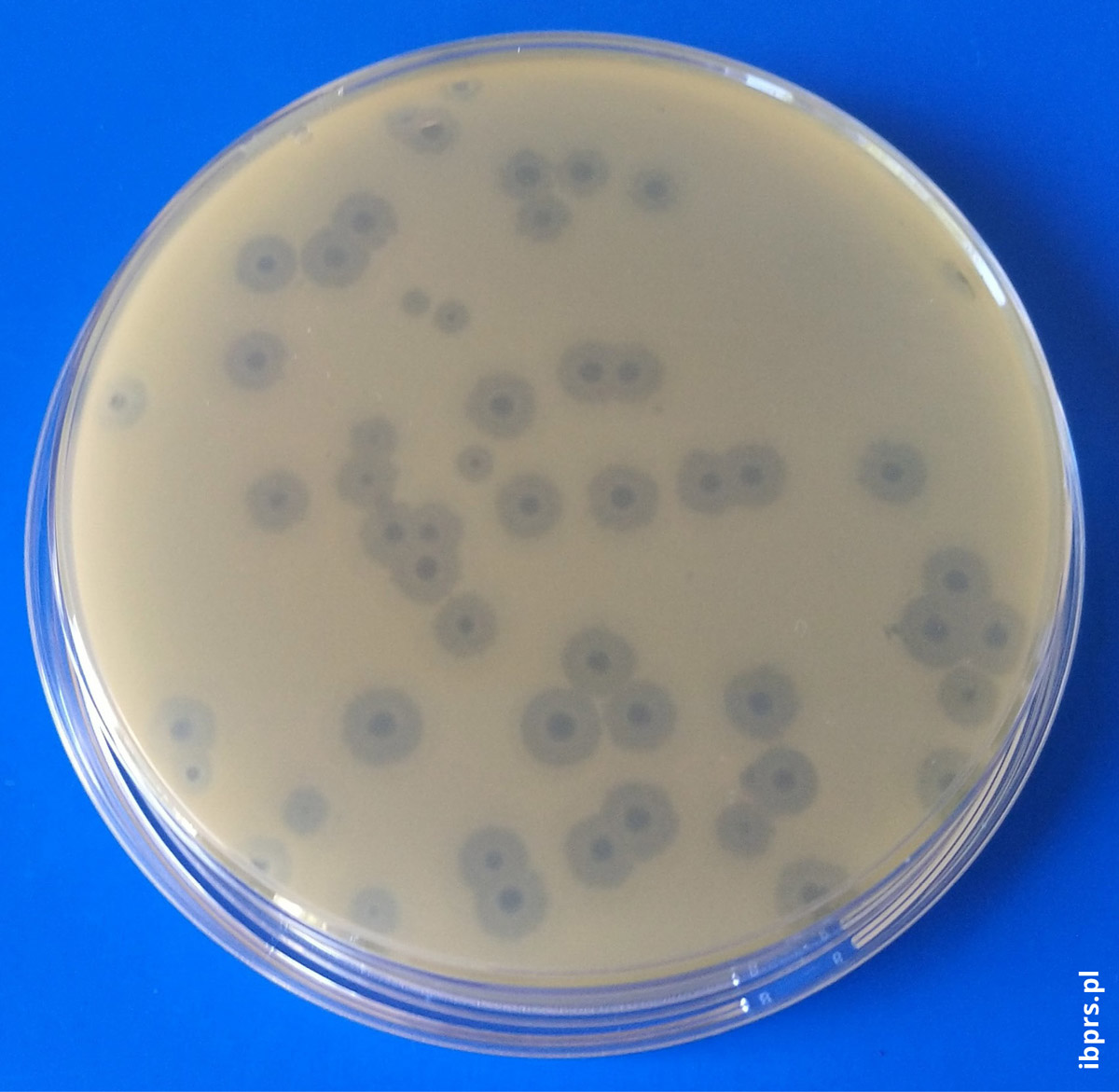
Autorzy:
Pracownicy Zakładu Mikrobiologii i Zakładu Bezpieczeństwa i Analizy Chemicznej Żywności IBPRS-PIB
o autorach:
dr hab. inż. Marek Roszko, prof. IBPRS-PIB
p.o. Kierownika Zakładu Bezpieczeństwa i Analizy Chemicznej Żywności. Prowadzi badania nad występowaniem i przemianą organicznych związków chemicznych, w tym zanieczyszczeń oraz związków bioaktywnych w żywności metodami chromatograficznymi sprzężonymi ze spektrometrią mas. Niedawna działalność naukowa skupia się również na metabolitach bakteryjnych, modyfikacji mikrobiomu żywności związkami bioaktywnymi, selekcji i identyfikacji mikroorganizmów zdolnych do wytwarzania lub degradacji wybranych chemikaliów.
dr hab. inż. Barbara Sokołowska, prof. IBPRS-PIB
p.o. Kierownika Zakładu Mikrobiologii. Specjalista w zakresie mikrobiologii żywności. Od wielu lat prowadzi badania nad skutecznością nowych, niekonwencjonalnych metod utrwalania żywności (głównie wysokiego ciśnienia hydrostatycznego), obejmujące inaktywację mikroorganizmów, subletalne uszkodzenia komórek oraz odpowiedź mikroorganizmów na stres występujący w procesach technologicznych. Ostatnio obszarem jej zainteresowań są badania nad zastosowaniem bakteriofagów jako niechemicznych, ekologicznych środków ochrony żywności oraz wykorzystanie technik metagenomiki w badaniach jakości i trwałości żywności.
dr hab. Edyta Juszczuk-Kubiak, prof. IBPRS-PIB
Kierownik Pracowni Biotechnologii i Inżynierii Molekularnej Zakładu Mikrobiologii. Biolog molekularny, posiada wiedzę i doświadczenie laboratoryjne z zakresu genomiki, proteomiki, epigenomiki. Prowadzi analizy NGS genomu i transkryptomu. Prowadzi badania dotyczące jakości i bezpieczeństwa mikrobiologicznego żywności w oparciu o wykorzystanie innowacyjnych technologii „food-omics”, obejmujących profilowanie taksonomiczne metagenomu żywności, monitorowanie dynamiki sukcesji metabolicznej mikroflory czy typowanie szczepów saprofitycznych i patogennych podczas etapów produkcji żywności, w celu opracowania odpowiednich procedur kontroli jakości i bezpieczeństwa żywności w całym łańcuchu żywnościowym.
mgr inż. Olga Świder
Technolog żywności ze specjalizacją w zakresie biotechnologii i mikrobiologii żywności. Doktorantka w IBPRS-PIB, gdzie w Zakładzie Bezpieczeństwa i Analizy Chemicznej Żywności prowadzi badania nad występowaniem amin biogennych w żywności, ze szczególnym uwzględnieniem żywności fermentowanej.
mgr inż. Michał Wójcicki
Technolog żywności ze specjalizacją w zakresie biotechnologii i mikrobiologii żywności. Doktorant w IBPRS-PIB, gdzie w Pracowni Biotechnologii i Inżynierii Molekularnej Zakładu Mikrobiologii wykorzystuje nowoczesne techniki biologii molekularnej do oceny możliwości zastosowania bakteriofagów w przemyśle spożywczym.
Wprowadzenie
Tradycyjne metody utrwalania żywności, takie jak: pasteryzacja, irradiacja, wykorzystanie chemicznych środków konserwujących oraz niekonwencjonalne technologie, jak przykładowo zastosowanie wysokich ciśnień (HHP), w różnym stopniu ograniczają wzrost i rozwój drobnoustrojów w środowisku produktu. Mogą obniżać wartość odżywczą produktów oraz wpływać na zmiany ich właściwości organoleptycznych (smaku, barwy). W przypadku produktów pochodzenia roślinnego niekiedy powodują modyfikacje struktury tkanek, które skutkują wyciekiem soku komórkowego [16,26]. Tradycyjne techniki zapewnienia bezpieczeństwa zdrowotnego żywności nie działają selektywnie w stosunku do drobnoustrojów i często prowadzą do eliminacji mikroflory pożytecznej [8,19], co ma szczególne znaczenie w przypadku produktów fermentowanych. Wobec powyższego, należy szukać nowych sposobów zapewnienia jakości i bezpieczeństwa mikrobiologicznego żywności, w szczególności rozwiązań nie chemicznych, ekologicznych, o ukierunkowanym przeciwdrobnoustrojowym podejściu. Poszukiwanie naturalnych środków biokontroli, które pozwolą na produkcję żywności bezpiecznej do spożycia przez ludzi i nie wpływających na smak, konsystencję i jakość odżywczą, jest ciągłym wyzwaniem dla różnych gałęzi przemysłu spożywczego [8].
Skoro biokontrola, to może bakteriofagi?
Jedną z obiecujących technik, która rozwiązuje kilka problemów technologicznych w przemyśle spożywczym jest biokontrola wzrostu bakterii przy udziale wirusów bakteryjnych, czyli bakteriofagów. Ta naturalna metoda wykorzystuje bakteriofagi lityczne izolowane ze środowiska, w celu „zaatakowania” bakterii chorobotwórczych i ich eliminacji z pożywienia (lub przynajmniej istotnego zmniejszenia ich poziomu) [19,27]. Bakteriofagi (fagi) jako naturalne drapieżniki bakterii wszechobecnie występujące w środowisku, są nieszkodliwe dla ludzi i zwierząt (ponieważ mogą namnażać się tylko w organizmach prokariotycznych). Zostały uznane za przyszłościowe środki przeciwdrobnoustrojowe, które mogą umożliwić kontrolę określonych patogenów bakteryjnych na każdym etapie produkcji żywności [8,27]. Wiodące ośrodki naukowe na całym świecie prowadzą badania nad zastosowaniem fagów do utrwalania żywności. Od czasu początkowej koncepcji stosowania bakteriofagów w przemyśle spożywczym powstało wiele raportów opisujących skuteczność stosowania preparatów fagowych w różnych produktach spożywczych. W ciągu ostatnich lat liczba dopuszczonych do stosowania w żywności preparatów bakteriofagowych stale rośnie [19]. Mimo pewnych wyzwań (np. ryzyka przenoszenia oporności na antybiotyki pomiędzy bakteriami przy udziale bakteriofagów czy możliwości „włączenia” bakteryjnych mechanizmów oporności fagowej), biokontrola przy użyciu bakteriofagów jest coraz częściej uznawana za atrakcyjną, niekonwencjonalną metodę zapewnienia bezpieczeństwa mikrobiologicznego żywności. Bakteriofagi nie wpływają na mikroflorę inną niż docelowa, co jest szczególnie istotne w produkcji żywności fermentowanej [13].
Komercyjne preparaty bakteriofagowe
Na światowym rynku zarejestrowanych jest wiele firm, które opracowują i dystrybuują preparaty bakteriofagowe dla przemysłu spożywczego. Środki te są ukierunkowane na zwalczanie patogennych bakterii w środowisku żywności, takich jak: Salmonella, Listeria monocytogenes, Escherichia coli O157:H7 czy Shigella [19,23]. Większość handlowych preparatów fagowych wykazuje istotną skuteczność w redukcji bakterii w środowisku żywności. Preparaty bakteriofagowe są zatwierdzone jako substancje pomocnicze w przetwórstwie żywności w wielu krajach, w tym: USA, Brazylii, Holandii, Izraelu, Kanadzie, Szwajcarii, Australii oraz Nowej Zelandii [19]. Dziesięć z nich otrzymało tymczasowy status GRAS (tj. uważane za bezpieczne, ang. Generally Recognised As Safe) nadany przez Agencję Żywności i Leków (FDA, ang. Food and Drug Administration) [12]. Ponadto, część komercyjnych preparatów posiada certyfikaty koszerności oraz Halal, a także jest dopuszczonych do stosowania przy produkcji żywności ekologicznej.

Tabela – komercyjne preparaty bakteriofagowe przeciwko Listeria monocytogenes
Preparaty przeciwko Listeria monocytogenes
Listeria monocytogenes jest patogenem przenoszonym przez żywność, który powoduje chorobę – listeriozę, stosunkowo rzadką, ale wysoce śmiertelną (wskaźnik śmiertelności na poziomie 19%, wskaźnik hospitalizacji – 99%). Jest szczególnie niebezpieczna dla osób z obniżoną odpornością (osoby starsze, kobiety w ciąży, noworodki). Źródłem zakażenia tymi pałeczkami może być żywność gotowa do spożycia (RTE, ang. Ready-To-Eat). Czas pomiędzy produkcją żywności z tego segmentu a jej spożyciem jest bardzo krótki i niewystarczający na stały monitoring i eliminację tych drobnoustrojów [11]. Inną grupą produktów spożywczych o wysokiej kontaminacji pałeczkami L. monocytogenes są blanszowane, mrożone owoce i warzywa oraz zioła [7].
Monitoring i pełna identyfikacja L. monocytogenes jest procedurą długotrwałą, stąd poszukiwane są inne, znacznie szybsze metody ich detekcji lub eliminacji. W ofercie firm biotechnologicznych aktualnie znajdują się tylko dwa preparaty (tabela 1), których działanie jest ukierunkowane na zwalczanie L. monocytogenes w produkcie oraz na urządzeniach bezpośrednio kontaktujących się z żywnością.
Europejski Urząd ds. Bezpieczeństwa Żywności (EFSA, ang. European Food Safety Authority) wydał opinię naukową w kwestii wykorzystania i sposobu działania bakteriofagów w produkcji żywności. EFSA zachęca do prowadzenia dalszych badań ukierunkowanych na zapobieganie ponownemu zakażeniu żywności patogenami bakteryjnymi oraz interakcjami bakteriofagpatogen i żywności [4]. Taka problematyka jest podejmowana przez zespół Zakładu Mikrobiologii Instytutu Biotechnologii Przemysłu Rolno-Spożywczego im. prof. Wacława Dąbrowskiego [15,21,27]. Skuteczność komercyjnych preparatów bakteriofagowych została potwierdzona w badaniach naukowych (tabela 2). Badania dowodzą o wysokiej skuteczności preparatu ListexTM P100 w redukcji biofilmu bakteryjnego. Doświadczenia Rodríguez- Melcón i wsp. [22] wskazują, że P100 w stężeniach równych lub większych niż 10^8 PFU/mL (jednostek tworzących łysinki/mL, ang. Plaque Forming Units/mL) skutecznie usuwa biofilmy L. monocytogenes z powierzchni polistyrenowych.
Stanowisko EFSA ws. komercyjnych preparatów bakteriofagowych
W 2012 roku Panel ds. Zagrożeń Biologicznych EFSA (BIOHAZ, ang. Panel on Biological Hazards) opracował opinię naukową dotyczącą oceny bezpieczeństwa i skuteczności preparatu Listex^TM P100 w usuwaniu powierzchniowego zanieczyszczenia surowych ryb pałeczkami Listeria monocytogenes [5]. Ten sam urząd w 2016 roku wydał raport zawierający ocenę bezpieczeństwa i skuteczności stosowania Listex^TM P100 do redukcji patogenów w produktach spożywczych typu RTE, takich jak: mięso i drób, ryby i owoce morza oraz produkty mleczne [6]. Produkt o nazwie handlowej Listex^TM P100 zawiera bakteriofaga P100 w stężeniu 2 x 10^11 PFU/mL. Szczegółowe dane dotyczące preparatu przedstawiono w tabeli 3.

EFSA ocenił preparat Listex^TM P100 pod kątem:
• bezpieczeństwa toksykologicznego substancji,
• skuteczności (czy stosowanie preparatu istotnie obniża poziom zanieczyszczenia L. monocytogenes w produktach typu RTE),
• możliwości pojawienia się zmniejszonej podatności na produkty biobójcze i/lub oporności na terapeutyczne środki przeciwdrobnoustrojowe w związku ze stosowaniem tej substancji,
• ryzyka związanego z uwalnianiem do środowiska ścieków z zakładu przetwórczego, związanych ze stosowaniem substancji.
Przy ocenie bezpieczeństwa stosowania preparatu Listex^TM P100 do odkażania żywności brano pod uwagę samego bakteriofaga P100, składniki i sposób wytwarzania produktu oraz możliwy wpływ na zdrowie konsumenta. Bakteriofagi wchodzące w skład preparatu Listex^TM P100 pierwotnie zostały wyizolowane ze ścieków mleczarni, należą do rodziny Myoviridae rzędu Caudovirales (fagi o budowie złożonej). Ich genom w postaci dsDNA o długości 131 kpz zawiera 174 białka kodujące ramki otwartego odczytu. Żadne z tych białek nie wykazuje toksycznego działania ani innych czynników zjadliwości. Fag P100 jest ściśle lityczny (wirulentny), co eliminuje możliwość konwersji lizogennej w przypadku zakażenia nowego gospodarza i przedstawia jednolity mechanizm pakowania genomu, którego dokładne rozpoznanie końców DNA zapobiega tworzeniu się bakteriofagów transdukcyjnych. Uważa się, że właściwości te mają zasadnicze znaczenie dla wykorzystania bakteriofagów w procesach odkażania żywności. Ponadto zakres gospodarzy P100 jest ograniczony tylko do rodzaju Listeria. P100 namnaża się w niepatogennym dla ludzi szczepie Listeria innocua.
Producent preparatu ma wdrożony plan HACCP oraz Dobre Praktyki Laboratoryjne, aby wyeliminować zanieczyszczenia, takie jak pestycydy lub metale ciężkie, które mogłyby wpłynąć na optymalny wzrost organizmu produkcyjnego. Nie wiadomo, czy szczep L. innocua użyty do namnażania P100 zawiera bakteriofagi łagodne, które mogą zanieczyścić preparat P100 i lizogenizować docelowe komórki L. monocytogenes po zastosowaniu Listex^TM P100 do odkażania żywności. Nawet jeśli, to możliwość przenoszenia przez nie determinantów wirulencji może zostać pominięta z uwagi na brak genów wirulencji u L. innocua oraz fakt, że bakteriofagi umiarkowane Listeria mają zwykle wąski zakres żywicieli (tj. te zakażające L. innocua nie zakażałyby L. monocytogenes) i dlatego nie byłyby możliwym wektorem transdukcyjnym. Badanie toksyczności po podaniu doustnym na szczurach karmionych cząstkami bakteriofaga P100 nie wykazało żadnych zmian w ich przeżywalności, masie ciała, zachowaniu lub wyglądzie, a wyniki sekcji zwłok były prawidłowe. Uważa się, że bakteriofagi są niepatogenne dla ludzi. Nie przewiduje się żadnych problemów związanych z objawami alergii po spożyciu bakteriofaga P100. Tylko jedno przypuszczalne białko bakteriofaga, gp71, wykazuje pewne podobieństwo sekwencji do znanych alergenów (gliadyny). Gp71 nie został wykryty wśród białek strukturalnych wirionów, co jest zgodne z lokalizacją kodującego go genu w klastrze rekombinacyjno-replikacyjnym wirusa.
Według producenta, od 2,5 do 9,5% naturalnie występujących szczepów Listeria wykazuje oporność na bakteriofaga P100, której mogą towarzyszyć zmiany w spektrum oporności na niektóre środki przeciwdrobnoustrojowe. Nie ma dostępnych raportów z badań środowiskowych stosowania Listex^TM P100. Przy braku odpowiedniego gospodarza bakteryjnego populacja bakteriofagów w czasie zmniejsza się w sposób naturalny, zatem prawdopodobieństwo przetrwania P100 w środowisku jest niskie.
Podsumowanie
W przemyśle spożywczym nieustannie obserwujemy problemy związane z obecnością drobnoustrojów patogennych dla człowieka. Największy problem stanowią pałeczki L. monocytogenes, które mogą tworzyć trudny do skutecznego zwalczania biofilm bakteryjny. Klasyczne techniki mycia i dezynfekcji linii produkcyjnych nie zawsze są wystarczająco skuteczne do niszczenia biofilmu, który często tworzony jest przez bakterie w miejscach trudno dostępnych (np. w zakrętach rurociągów). Zastosowanie biologicznych preparatów zawierających lityczne bakteriofagi może rozwiązać ten problem w zakładach przemysłu spożywczego. Zawiesina fagów może być stosowana zarówno do bezpośredniego kontaktu z żywnością, jak również jako środek poprawiający skuteczność dezynfekcji linii produkcyjnej.
Niestety, mimo dopuszczenia do wykorzystania komercyjnych preparatów bakteriofagowych w przemyśle rolno-spożywczym w wielu krajach, w Polsce do tej pory żaden z tych środków nie uzyskał zezwolenia do stosowania. Pomimo ograniczeń nie wpływa to na zaprzestanie badań nad zastosowaniem fagów w przemyśle spożywczym, prowadzonych przez ośrodki naukowe w Polsce i za granicą.
Literatura
1. Axelsson, L., Bjerke, G.A., Mcleod, A., Berget, I., Holck, A.L. (2020): Growth behavior of Listeria monocytogenes in a traditional Norwegian fermented fish product (Rakfisk), and its inhibition through bacteriophage addition. Foods, 9, 1–16.
2. Baños, A., García-López, J.D., Núñez, C., Martínez-Bueno, M., Maqueda, M., Valdivia, E. (2016): Biocontrol of Listeria monocytogenes in fish by enterocin AS-48 and Listeria lytic bacteriophage P100. LWT – Food Science and Technology, 66, 672-677.
3. Dyrektywa FSIS USDA 7120.1 wersja 52 z dnia 1 października 2019 r. Safe and suitable ingredients used in the production of meat, poultry and egg products.
4. EFSA (2009): The use and mode of action of bacteriophages in food production. Scientific opinion of the Panel on Biological Hazards. The EFSA Journal, 1076, 1-26.
5. EFSA (2012): Scientific Opinion on the evaluation of the safety and efficacy of ListexTM P100 for the removal of Listeria monocytogenes surface contamination of raw fish.
The EFSA Journal, 10, 3, 2615.
6. EFSA (2016): Evaluation of the safety and efficacy of ListexTM P100 for reduction of pathogens on different ready-to-eat (RTE) food products. EFSA panel on biological hazards. The EFSA Journal, 14, 8, 1-94.
7. EFSA (2020): The public health risk posed by Listeria monocytogenes in frozen fruit and vegetables including herbs, blanched during processing. The EFSA Journal, 18, 4, 6092.
8. Endersen, L., Coffey, A. (2020): The use of bacteriophages for food safety. Current Opinion in Food Science, 36, 1-8.
9. Gutiérrez, D., Rodríguez-Rubio, L., Fernández, L., Martínez, B., Rodríguez, A., García, P. (2017): Applicability of commercial phage-based products against Listeria monocytogenes for improvement of food safety in Spanish dry-cured ham and food contact surfaces. Food Control, 73, 1474-1482.
10. Ishaq, A., Syed, Q.A., Ebner, P.D., ur Rahman, H.U. (2020): Multiple hurdle technology to improve microbial safety, quality and oxidative stability of refrigerated raw beef. LWT – Food Science and Technology, 110529.
11. Jordan, K., Hunt, K., Lourenco, A., Pennone, V. (2018): Listeria monocytogenes in the Food Processing Environment. Current Clinical Microbiology Reports, 5, 106–119.
12. Kahn, L.H., Bergeron, G., Bourassa, M.W., De Vegt, B., Gill, J., Gomes, F., Malouin, F., Opengart, K., Ritter, G.D., Singer, R.S., Storrs, C., Topp, E. (2019): From farm management to bacteriophage therapy: strategies to reduce antibiotic use in animal agriculture. Ann. N. Y. Acad. Sci., Special Issue: Antimicrobial resistance from food animal production, 31-39.
13. Kawacka, I., Olejnik-Schmidt, A., Schmidt, M., Sip, A.
(2020): Effectiveness of Phage-Based Inhibition of Listeria
monocytogenes in Food Products and Food Processing Environments. Microorganisms, 8, 1764.
14. Komora, N., Maciel, C., Pinto, C.A., Ferreira, V., Brandão, T.R.S., Saraiva, J.M.A., Castro, S.M., Teixeira, P. (2020): Nonthermal approach to Listeria monocytogenes inactivation in
milk: The combined effect of high pressure, pediocin PA-1 and bacteriophage P100. Food Microbiology, 86, 103315.
15. Kowalska, M., Sokołowska, B. (2016): Wykorzystanie bakteriofagów w łańcuchu żywnościowym. Żywność Nauka Technologia Jakość, 4, 107, 26-36.
16. Lewis, R., Bolocan, A.S., Draper, L.A., Ross, R.P., Hill, C. (2019): The effect of a commercially available bacteriophage and bacteriocin on Listeria monocytogenes in Coleslaw. Viruses, 11, 977, 1-12. 17. Sadekuzzaman, M., Yang, S., Mizan, M.F.R., Kim, H-S., Ha, S-D. (2017): Effectiveness of a phage cocktail as a biocontrol agent against L. monocytogenes biofilms. Food Control, 78, 256-263.
18. Miguéis, S., Saraiva, C., Esteves, A. (2017): Efficacy of LISTEX P100 at Different Concentrations for Reduction of Listeria monocytogenes Inoculated in Sashimi. Journal of Food Protection, 80, 12, 2094–2098.
19. Moye, Z.D., Woolston, J., Sulakvelidze, A. (2018): Bacteriophage Applications for Food Production and Processing. Viruses, 10, 4, 205.
20. Prabhu, G., Husak, R., Peterson, R., Hagens, S., Iancu, C., Riemer, Y., Engle, R. (2018): Validation of the Effect of Listex P100 Bacteriophage on Survival of Listeria monocytogenes. Meat and Muscle Biology, 1, 2.
21. Połaska, M., Sokołowska, B. (2019): Bacteriophages – a new hope or huge problem in the food industry. AIMS – Microbiology 5, 4, 324-346.
22. Rodríguez-Melcón, C., Capita, R., García-Fernández, C., Alonso-Calleja, C. (2018): Effects of Bacteriophage P100 at Different Concentrations on the Structural Parameters of Listeria monocytogenes Biofilms. Journal of Food Protection, 81, 12, 2040-2044.
23. Svircev, A., Roach, D., Castle, A. (2018): Framing the future with bacteriophages in agriculture. Viruses, 10, 218, 1-13.
24. Yang, S., Sadekuzzaman, M., Ha, S-D. (2017a): Reduction of Listeria monocytogenes on chicken breasts by combined treatment with UV-C light and bacteriophage ListShield.
LWT, 86, 193-200.
25. Yang, S., Sadekuzzaman, M., Ha, S-D. (2017b): Treatment with lauric arginate ethyl ester and commercial bacteriophage, alone or in combination, inhibits Listeria monocytogenes in chicken breast tissue. Food Control, 78, 57-63.
26. Vermeulen, A., Devlieghere, F., Ragaert, P. (2018): Optimal packaging design and innovative packaging technologies for minimally processed fresh produce, In F. Pérez-Rodríguez, P. Skandamis, V. Valdramidis (Eds.), Quantitative methods for food safety and quality in the vegetable industry (pp. 193- 212). Springer, Cham.
27. Wójcicki, M., Błażejak, S., Gientka, I., Brzezicka, K. (2019): The concept of using bacteriophages to improve the microbiological quality of minimally-processed foods. Acta Scientarum Polonorum Technologia Alimentaria, 18, 4, 373–383.
28. Zbikowska, K., Michalczuk, M., Dolka, B. (2020): The Use of Bacteriophages in the Poultry Industry. Animals, 10, 872.
Artykuł ukazał się w publikacji FoodFakty Nawigator: Listeria w przemyśle spożywczym.